Valutazione Clinica
Progettazione & Engineering
Progettazione Meccanica
Rapid Prototyping
Reverse Engineering
Simulazioni FEM
Qualità e Validazione
Sistema Qualità
Validazione DQ IQ OQ PQ
Procedure Operative (SOP) (IOP)
Fascicolo Tecnico / Design Dossier
Design Control
DHF Design History File
Analisi e Gestione del Rischio
Valutazione Clinica
Testing
Test Meccanici
Analisi su Polimeri
Valutazione della Sicurezza Biologica
Con il nostro team di scienziati, ingegneri e statistici con numerosi anni di esperienza nazionale ed internazionale nei settori clinici, preclinici e tecnici siamo in grado di supportare l'azienda nello svolgimento della valutazione clinica ossia la valutazione e l'analisi dei dati clinici relativi a un dispositivo medico per verificarne la sicurezza clinica e le prestazioni.
La valutazione clinica è un processo continuo, effettuato per tutto il ciclo di vita di un dispositivo medico.
Quando si posiziona un dispositivo medico sul mercato, il fabbricante deve aver dimostrato attraverso l'utilizzo di appropriate procedure di valutazione della conformità che il dispositivo è rispondente ai requisiti essenziali pertinenti che coprono la sicurezza e le prestazioni. In generale, dal punto di vista clinico, si prevede che il fabbricante abbia dimostrato che il dispositivo sia in grado di raggiungere le prestazioni previste durante le normali condizioni di impiego e che i rischi noti e prevedibili, ed eventuali eventi avversi, siano ridotti al minimo accettabile in rapporto ai benefici della prestazioni attese, oltre e che le affermazioni fatte sulle prestazioni del dispositivo e la sicurezza (ad esempio, l'etichettatura dei prodotti e istruzioni per l'uso) siano supportati da evidenze oggettive.
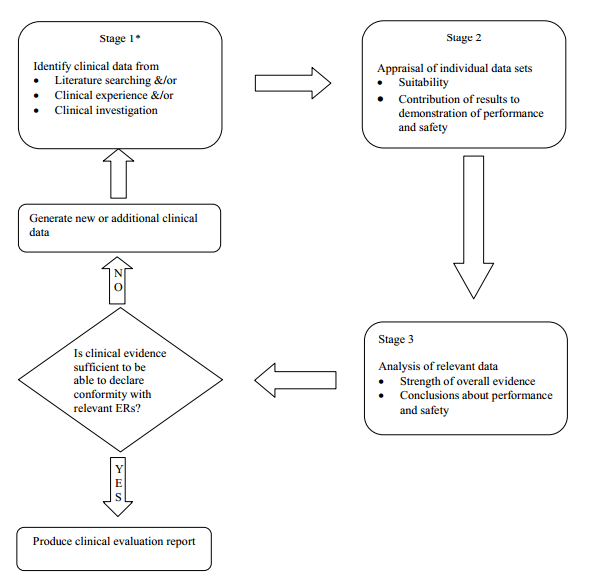
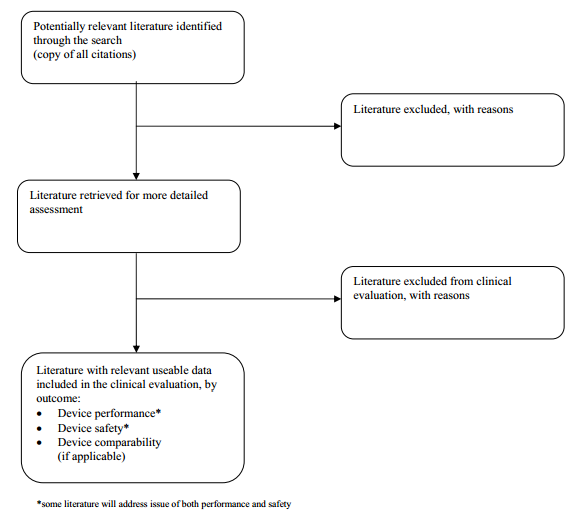
Una volta che il campo di applicazione è stato definito, ci sono tre fasi distinte di esecuzione di una valutazione clinica:
• individuazione delle norme pertinenti e dei dati clinici;
• valutazione di ogni singolo set di dati, in termini di rilevanza e applicabilità
• analisi dei singoli insiemi di dati, dove sono riportate le conclusioni circa le prestazioni, la sicurezza e gli aspetti di design (etichettatura, le informazioni e le istruzioni per l'uso del paziente) del dispositivo.
Le fonti dei dati / documenti utilizzati in una valutazione clinica possono essere raccolti da:
- Dati generati attraverso la ricerca bibliografica
- Dati generati attraverso l'esperienza clinica
- Dati provenienti dagli studi clinici
Dati generati attraverso la ricerca bibliografica
La letteratura clinica può essere utilizzata per identificare pubblicazioni riportanti dati clinici che non sono in possesso del produttore e che possono aiutare il produttore a stabilire le prestazioni accettabili ad assicurare la sicurezza di un dispositivo medico. I dati generati attraverso la ricerca bibliografica possono riguardare direttamente il dispositivo in questione (ad esempio, rapporti di indagini cliniche del dispositivo in questione, che sono state eseguite da terzi, segnalazioni di eventi avversi) o dispositivi equivalenti.
Dati generati attraverso l'esperienza clinica
Questi tipi di dati clinici sono generati attraverso l'uso clinico e possono riguardare sia il dispositivo in questione che dispositivi equivalenti. Tali tipi di dati possono includere:
• rapporti di sorveglianza post-commercializzazione del produttore, registri o studi (che possono riguardare dati di performance o di sicurezza a lungo termine);
• eventi avversi database (in possesso del fabbricante o dell' Autorità di Vigilanza);
• dettagli delle azioni correttive.
Dati provenienti dagli studi clinici
Gli studi clinici devono generalmente essere condotti in conformità alla norma EN ISO 14155, Parts 1 and 2, Clinical Investigations of Medical Devices for Human Subjects, ed in conformità alle normative locali. Si riconosce che dove i produttori si avvalgano di dati di indagine riportati nella letteratura scientifica (cioè indagini relative al dispositivo in questione o equivalenti dispositivi che vengono svolte da un terzo), la documentazione da includere nella valutazione clinica è lo stesso documento pubblicato.
La letteratura del prodotto e le istruzioni per l'uso devono essere rivisti per assicurare che siano coerenti con i dati e che tutti i pericoli e le altre informazioni rilevanti clinicamente siano stati identificati in modo appropriato.
POSSIBILE METODOLOGIA PER LO SCREENING E LA SELEZIONE DEI DATI DA INCLUDERE IN UNA VALUTAZIONE CLINICA